Archivos Mensuales: marzo 2013
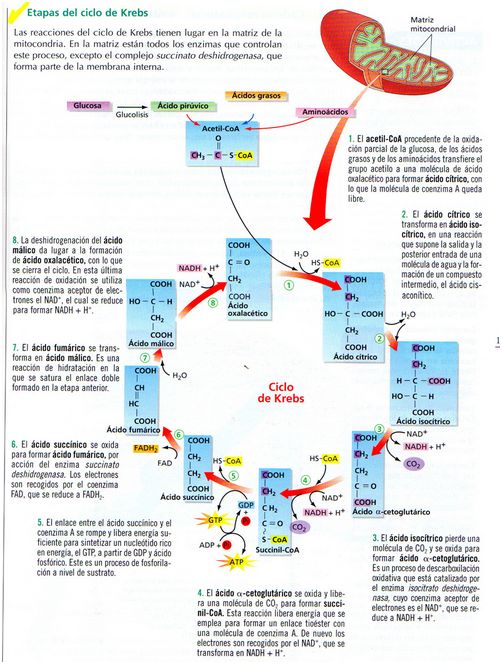
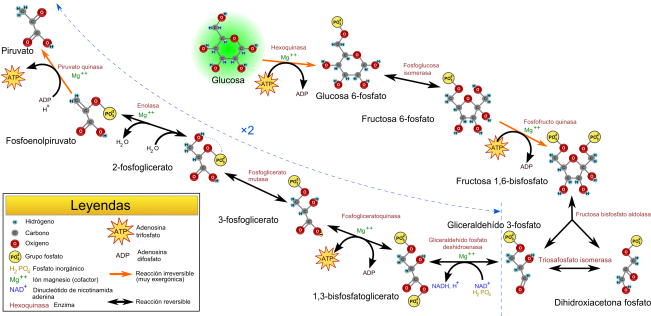
GLUCOLISIS
ENZIMAS
ASPECTOS IMPORTANTES:
•Son proteínas (a.a)
• Son biocatalizadores.
•Energía de activación–> es la energía cinética mínima que se necesita en un sistema para iniciar un determinado proceso o reacción.
• CARACTERISTICAS:
•• Se aceleran la velocidad de una reacción cientos a millones de veces.
•• las enzimas no se modifican ni se pierden en una reacción.
••El mismo tipo de enzima cataliza o actúa en procesos reversibles ( hacia la derecha y hacia la izquierda).
•• Las enzimas tiene sustancias especificas y son selectivas.
• SELECTIVIDAD DE LAS ENZIMAS:
•• Determina los procesos químicos.
••Cada enzima es tridimensional y única, (estructura terciaria),
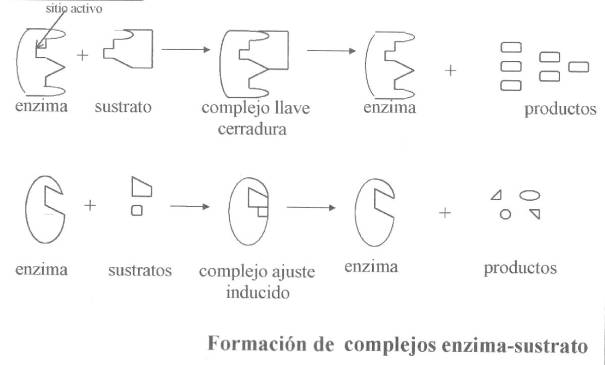
•• Cada enzima tiene como mínimo un sitio activo. –> Sustrato – enzimas.
–>Amilasa – almidón.
–> Lipasa – lípidos.
TRABAJO DE UNA ENZIMA:
http://www.botanica.cnba.uba.ar/Pakete/6to/Enzimas_archivos/image007.jpg
•La luz sobre las enzimas puede actuar sobre millones de moléculas de sustrato.
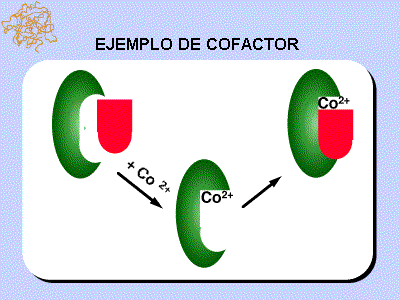
•cofactores–> inorgánicos –> cobre, metal, hierro, magnesio.
• Coenzimas –> orgánicas –>FAD; FMN; NAD+; Coenzima A.
• FACTORES QUE AFECTAN LA CTIVIDAD ENZIMATICA:
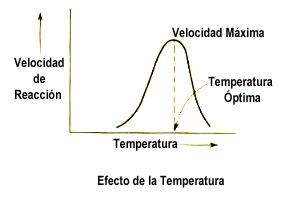
•• Físicos –> temperatura – pH
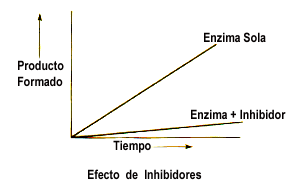
• Reacción –> inhibidor – cofactor
• Los inhibidores enzimáticos son moléculas que se unen a enzimas y disminuyen su actividad. Puesto que el bloqueo de una enzima puede matar a un organismo patógeno o corregir un desequilibrio metabólico, muchos medicamentos actúan como inhibidores enzimáticos.
•CLASIFICACIÓN:
••Oxidoreductasa–>transferencia de electrones.
••Transferasas –> transferencia de grupos funcionales.
••Hidrolasas –> Reacciones de hidrolisis.
••Liasas –> adición de dobles enlaces.
••Isomerasas –> Reacciones de isomerización.
•• Ligasas –> Formación de enlaces ATP.
• Un cofactor es un componente no proteico, termoestable y de baja masa molecular, necesaria para la acción de una enzima. El cofactor se une a una estructura proteica denominada apoenzima, y a este complejo se le denomina holoenzima, la holoenzima es el complejo apoenzima-cofactor.
METABOLISMO
Aspectos importantes:
• es la inifinidad de areacciones quimicas que ocurren dentro de una celula.
• todas las transformaciones quimicas y energeticas.
• Anabolismo: Tienen como resultado la síntesis de componentes celulares a partir de precursores de baja masa molecular, por lo que recibe también el nombre de biosíntesis.
•Catabolismo: Consiste en la transformación de biomoléculas complejas en moléculas sencillas y en el almacenamiento adecuado de la energía química desprendida en forma de enlaces de alta energía en moléculas de adenosín trifosfato.
• Una via napleurotica es aquella que se da o se produce de una via anabolica o una via catabolica y viceversa.
•Metabolito intermediario: es el producto de una reaccion y el comienzo de otra.
• Transformacion del ATP–> AMP–> ADP
• NAD–> 3 ATP.
•FAD –>2 ATP.
• FUNCIONES:
••Digestión –> energetico; obtención; alimentacón.
••Construcción–> Forma biomoléculas y crecimiento celular –> expanción y renovación.
••Reproducción –>Mantener una especie.
•• Eliminación–> Proceso de regulacion –> expulsión.
REACCIONES QUIMICAS
REACCIONES QUIMICAS BIOLOGICAS
• REACCIÓN EXERGÓNICA–> O ESPONTANEA: Es una reacción química donde la variación de la energía libre de gibbs es negativa. Esto nos indica la dirección que la reacción seguirá. A temperatura y presión constantes una reacción exergónica se define con la condición:

Que describe una reacción química que libera energía en forma de calor, luz, etc. Las reacciones exergónicas son una forma de procesos exergónicos en general o procesos espontáneos y son lo contrario de las reacciones endergónicas. Se dijo que las reacciones exergónicas transcurren espontáneamente pero esto no significa que la reacción transcurrirá sin ninguna limitación o problema.
•REACCIÓN ENDERGÓNICA –> O NO ESPONTANEAS: Es una reacción química en donde el incremento de energía libre es positivo.
Bajo condiciones de temperatura y presión constantes, esto quiere decir que el incremento en la energía libre de Gibbs estándar debe ser positivo.

•REACCIÓN ACOPLADA--> puede pasar de una reacción endergónica a una exergónica y viceversa.
http://es.wikipedia.org/w/index.php?search=endergonicas&title=Especial%3ABuscarENERGIA DE GIBBS
En termodinámica, la energía libre de Gibbs es un potencial termodinámico, es decir una función de estado extensiva con unidades de energía que da la condición de equilibrio y de espontaneidad para una reacción química.
• CALCULO DE LA ENERGIA LIBRE: los cambios de la energía libre son:
•• Contenido de calor (T) temperatura.
•• Entropía del sistemas (S).
• fue desarrollada en los años 1870 por el fisco – matemático estadounidense Williard Gibbs.
• ENERGIA LIBRE DE GIBBS:
••FORMULAS:
•••G–> Energia de gibbs.
•••H –> Entalpia.
•••T–>Temperatura.
•••S–>Entropia
•••ΔG–>Cambio de la energia libre.
• CAMBIOS:
ΔG = ΔH – TΔS
•Contribucion termica de la entalpia:
–> Espontanea
–> No espontanea
• >0 (menor) ; < 0 (mayor).
• ASPECTOS IMPORTANTES:
• ΔH <0= se favorece los procesos de tipo exotermico –> libera temperatura.
•ΔH>0= va a producirse con dificualtad procesos endotermicos–> ingreso de temperatura.
•ΔH –> (-) –> Exotermico.
•ΔH –> (+) –> Endotermico.
•ΔS –> (+) –> Espontaneo.
•ΔS –> (-) –> No espontaneo.
TERMODINAMICA Y METABOLISMO
Aspectos importantes:
• Flujo de energia: Capacidad de generar cambio en el estado de la materia o su movimiento.
• Existen dos tipos de flujo de energia: cinetica y potencial.
• •Energia cientica: es aquella energia que posee un cuerpo debido a su movimiento.
http://es.wikipedia.org/wiki/Energ%C3%ADa_cin%C3%A9tica
••Energia potencial: es la capacidad de hacer trabajo en virtud de la posicion o estado de una masa.
http://es.wikipedia.org/wiki/Energ%C3%ADa_potencial•Electricidad: movimiento de electrones.
•FLUJO DE ENERGIA (depende de la energia inicial disponible, utilidad de la energia, se rige por las leyes de la termodinamica)–> fotosintesis(plantas); luz –> carbohigratos; cinetica–> energia potencial quimica.
•LEYES DE LA TERMODINAMICA: describe propiedades y comportamientos de la energia en los sistemas.
•• 1ra ley : la energia no se crea ni se destruye, solo se transforma.
••2da ley: la energia tienen de difundirse de una forma mas concentrada a una menos concentrada.
••3ra ley: cero absoluto–> si no hay entropia (falta de desorden), no hay perdida ni ganacia de energia.
•REACCIONES:
••Endergonicas o No espontaneas: Son aquellas que requieren un aporte de energia del esterior.
••Exergonicas o expontaneas: Son aquellas que ocurren sin ninguna intervencion externa y generan energia libre disponible para desarrollas un trabajo.
• FORMULA:
• E–>Capacidad de realizar un trabajo.
•W–> Trabajo.
MONOSACÁRIDOS
DISACÁRIDOS Y POLISACÁRIDOS
ENLACE PEPTÍDICO Y FOSFODIESTER
• Enláce Peptídico: Une los átomos unos a otros para formar las proteínas. La unión de dos aminoácidos con la pérdida de una molécula de agua resulta en la formación de un grupo funcional del tipo amida que recibe el nombre de enlace peptídico.
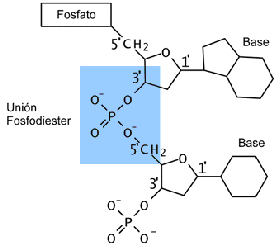
• Enláce Fosfodiéster: Es un tipo de enláce covalente que se produce entre un grupo hidroxilo (OH-) en el carbono 3, y un grupo fosfáto (PO4 -1) en el carbono 5 de nucleótido entrante formandose así un doble enlace éster. En esta reacción se libera una molécula de agua y se forma un dinucleótido, son representables del esqueleto de las hebras del ADN y ARN.